Паразитичний черв’як Schistosoma mansoni, який викликає шистосомоз, здатен проникати в організм господаря, не спричиняючи болю чи свербежу. Вчені з Медичної школи Тулейнського університету (США) з’ясували, як саме: черв’як блокує роботу нейронів, що відповідають за передачу сигналів болю та активацію імунної відповіді. Результати дослідження опубліковані в журналі The Journal of Immunology. Про це повідомляє медіа про науку, технології та здоров’я КРВ.медіа з посиланням на текст дослідження.
Механізм зараження: чому біль не виникає
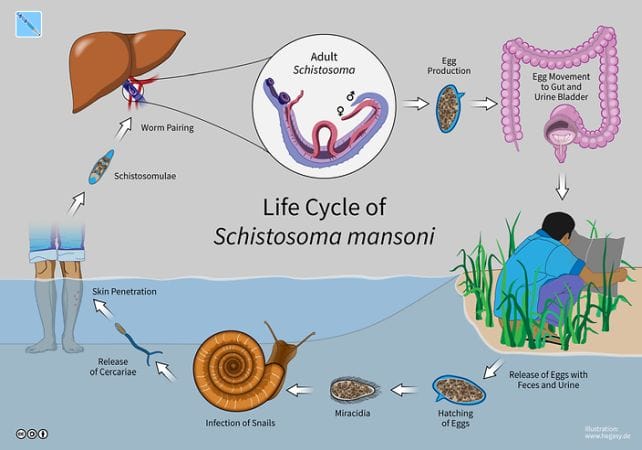
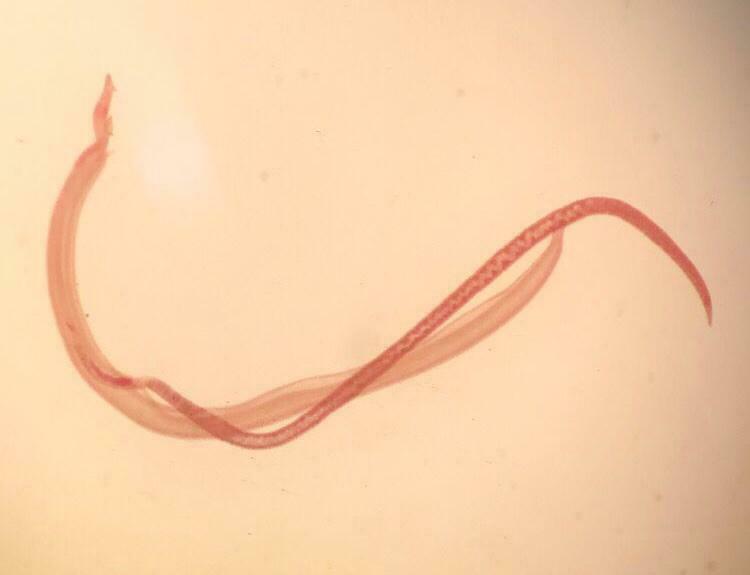
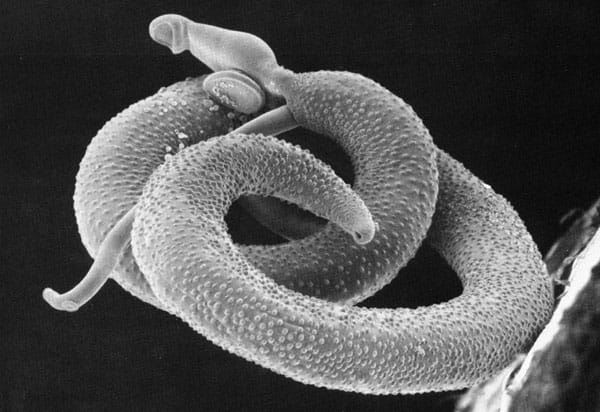
Водяний паразит Schistosoma mansoni має складний цикл розвитку. Його личинки здатні проникати через шкіру людини під час контакту з прісною водою, інфікованою проміжним господарем — прісноводними равликами. Найбільш вражаючим аспектом цього процесу є те, що зараження відбувається без болю чи подразнення, що дозволяє паразитові залишатися непоміченим.
Вчені встановили, що S. mansoni виділяє молекули, які здатні блокувати специфічний тип сенсорних нейронів — TRPV1+. Ці нейрони зазвичай відповідають за передачу сигналів болю, тепла, свербежу, а також ініціюють запальні реакції, які можуть перешкодити проникненню паразита.
Шистосомоз: захворювання, яке вражає мільйони
Schistosoma mansoni є збудником шистосомозу — хронічного паразитарного захворювання, яке найчастіше зустрічається у тропічних регіонах Африки, Азії та Південної Америки. За даними Всесвітньої організації охорони здоров’я, понад 200 мільйонів людей у світі інфіковані цим паразитом.
Хвороба вражає печінку, кишківник, сечостатеву систему, викликає кров у сечі чи калі, біль у животі, хронічну втому. Без лікування можливе ураження печінки або навіть нервової системи. Лікування існує, але зараження часто залишається непоміченим на ранніх стадіях — частково через здатність паразита уникати імунної відповіді.
Дослід на мишах підтвердив гіпотезу
Щоб перевірити вплив паразита на больові відчуття, дослідники провели серію експериментів на лабораторних мишах. Одну групу тварин інфікували S. mansoni, а іншу залишили як контрольну. Науковці не знали, яка саме група інфікована, що виключило можливість упередженості — метод називається «сліпим» дослідженням.
Усі миші проходили стандартний тест: їхню лапку поміщали над джерелом тепла, не достатньо гарячим для опіку, але дискомфортним. Час реакції — скільки секунд миша тримала лапку — виявився значно довшим у заражених тварин. Це свідчить про знижену чутливість до болю.
Крім того, вчені ізолювали нейрони зі спинного мозку мишей обох груп та виростили їх у лабораторних умовах. Потім до клітин додали капсаїцин — речовину, яка міститься в перці чилі й активує TRPV1+. У нейронних культурах заражених мишей реакція була значно слабшою, ніж у контрольної групи.
TRPV1+ нейрони: важливий елемент болю та імунітету
TRPV1+ — це тип сенсорних нейронів, які виконують не лише роль «датчиків болю», але й активують імунну відповідь. Коли ці клітини виявляють небезпеку — як-от токсини, інфекції або надмірне тепло — вони запускають сигнали, які стимулюють запальний процес.
Цей процес у звичайних умовах допомагає організму захищатися, зокрема блокує вторгнення паразитів. Тому здатність S. mansoni «вимикати» TRPV1+ нейрони підвищує його шанси на успішне зараження. Паразит не лише приглушує біль — він обходить природний імунний бар’єр, який мав би зупинити інфекцію.
Нові горизонти медицини: потенціал для знеболення
Одне з найбільш перспективних напрямків, яке випливає з цього дослідження — пошук нових анальгетиків. Молекули, що блокують TRPV1+, можуть стати альтернативою до опіоїдних препаратів, які мають значні побічні ефекти та високий ризик залежності.
«Якщо нам вдасться ідентифікувати і виділити ці молекули, ми зможемо створити нові засоби для лікування хронічного болю та запальних захворювань», — зазначив імунолог Де’Броскі Герберт із Тулейнської школи медицини.
Окрім цього, вчені розглядають можливість створення профілактичних засобів — наприклад, крему або гелю, який активуватиме TRPV1+ на шкірі й перешкоджатиме зараженню при контакті з потенційно інфікованою водою.
Наразі команда дослідників планує детальніше вивчити структуру та функції молекул, які виділяє S. mansoni. Хоча результати на мишах є переконливими, залишається відкритим питання: наскільки подібно реагуватиме людський організм?
Крім того, науковці обережно підходять до використання таких молекул у клінічній практиці, оскільки імунне пригнічення може нести потенційні ризики, зокрема підвищену вразливість до інших інфекцій.
Попри це, відкриття відкриває нові напрями у вивченні як паразитарних захворювань, так і механізмів больової чутливості загалом.
Раніше ми писали про те, що нічне освітлення міст підвищує ризик хвороб серця